Т. Ізопроцесси - PhysBook
Окремі випадки рівняння стану ідеального газу
Процеси, при яких один з параметрів p, V або Τ залишається постійним, називають ізопроцессамі. Закони, що описують ізопроцесси в ідеальному газі, були відкриті експериментально задовго до створення MKT ідеального газу.
а) Ізотермічний процес - процес зміни стану газу при постійній температурі: Τ = const. Для його здійснення треба посудину з поршнем, наповнений газом, привести в контакт з термостатом, тобто тілом настільки великої маси, що вона забезпечує сталість температури газу, навіть коли віддає газу або отримує від нього деяку кількість теплоти.
В рівнянні (3) при m = const і Μ = const \ (~ \ frac mM RT = \ operatorname {const} \). тоді маємо
\ (~ PV = \ operatorname {const} \) або для двох станів \ (~ p_1V_1 = p_2V_2. \ Qquad (1) \)
Формули (1) описують закон Бойля-Маріотта: при постійній температурі, незмінній масі і незмінному хімічному складі газу добуток тиску на об'єм є величина постійна.
Графіки залежності між параметрами даної маси при постійній температурі називаються изотермами. На малюнку 1 зображені ізотерми в осях (p, V), (V, Τ), (p, Т).
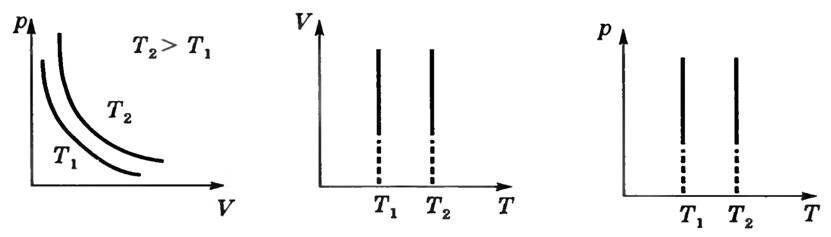
Мал. 1
б) Ізобарний процес - процес зміни стану газу при постійному тиску: p = const. з рівняння (3) \ (~ \ frac VT = \ frac {mR} {Mp} \) відношення \ (~ \ frac {mR} {Mp} = \ operatorname {const} \) при m = const, Μ = const. отже,
\ (~ \ Frac {V} {T} = \ operatorname {const} \), або \ (~ \ frac {V_1} {T_1} = \ frac {V_2} {T_2}. \ Qquad (2) \)
Рівняння (2) описують закон Шарля: обсяг даної маси газу при постійному тиску і постійному хімічному складі прямо пропорційний абсолютній температурі.
Закон Шарля можна записати через температуру t, вимірювану за шкалою Цельсія \ [~ V = V_0 (1 + \ alpha t) \], де V 0 - обсяг газу при 0 ° С, α = 1/273 К-1 - температурний коефіцієнт об'ємного розширення.
Графіки залежності між параметрами газу при постійній масі газу і тиску називають изобарами (рис. 2).
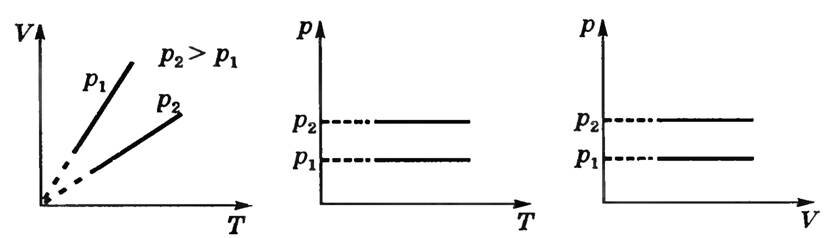
Мал. 2
в) Ізохорний процес - процес зміни стану газу при постійному обсязі: V = const. з рівняння (3) \ (~ \ Frac pT = \ frac {mR} {MV} \). Для даної маси газу m = const і Μ = const відношення \ (~ \ frac {mR} {V} = \ operatorname {const} \) і
\ (~ \ Frac {p} {T} = \ operatorname {const} \), або \ (~ \ frac {p_1} {T_1} = \ frac {p_2} {T_2}. \ Qquad (3) \)
Рівняння (3) описують закон Гей-Люссака: тиск даної маси газу при постійному обсязі і постійному хімічному складі прямо пропорційно абсолютній температурі.
Якщо температуру вимірювати за шкалою Цельсія, то закон Гей-Люссака запишеться у вигляді \ [~ p = p_0 (1 + \ alpha t) \], де p 0 - тиск газу при 0 ° С, α - температурний коефіцієнт тиску, який опинився однаковим для всіх газів: α = 1/273 К-1.
Графіки залежності між параметрами газу при постійній масі газу і постійному обсязі називають Ізохор (рис. 3).
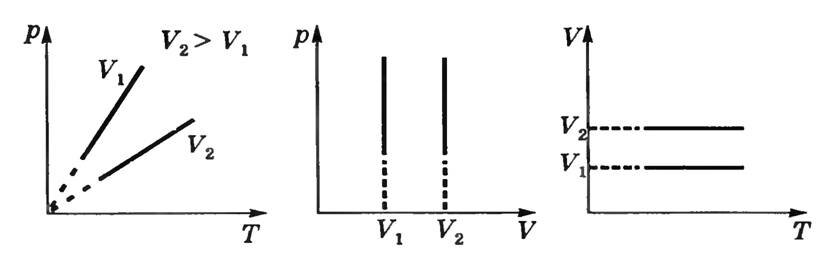
Мал. 3
Ретельна експериментальна перевірка сучасними методами показала, що рівняння стану ідеального газу і що випливають з нього закони Бойля-Маріотта, Гей-Люссака і Шарля досить точно описують поведінку реальних газів при невеликих тисках і не дуже низьких температурах.
література
Аксеновіч Л. А. Фізика в середній школі: Теорія. Завдання. Тести: Учеб. посібник для установ, що забезпечують отримання заг. середовищ, освіти / Л. А. Аксеновіч, Н.Н.Ракіна, К. С. Фаріно; Під ред. К. С. Фаріно. - Мн .: Адукация i вихаванне, 2004. - C. 144-146.